원자가: 가장 바깥쪽 껍질 또는 원자가 껍질에 있는 전자를 원자가 전자라고 합니다. 이 원자가 전자는 화학 원소의 화학적 특성을 담당합니다. 다른 원소와의 화학 반응에 참여하는 것은 바로 이 전자입니다. 간단한 반응에 적용할 수 있는 지나치게 단순화된 화학 규칙은 원자가 8개의 전자(L 껍질의 경우 2개)로 구성된 완전한 바깥쪽 껍질을 형성하려고 한다는 것입니다. 원자는 몇 개의 전자를 내주어 기본적인 완전한 껍질을 노출시킬 수 있습니다. 원자는 몇 개의 전자를 받아들여 껍질을 완성할 수 있습니다. 이 두 가지 과정은 원자로부터 이온을 형성합니다. 원자는 바깥쪽 껍질을 완성하기 위해 원자들 간에 전자를 공유할 수도 있습니다. 이 과정은 분자 결합을 형성합니다. 즉, 원자는 연합하여 분자를 형성합니다.
지휘자
예를 들어, 그룹 I 원소: Li, Na, K, Cu, Ag, Au는 단일 원자가 전자를 가지고 있습니다. (아래 그림) 이러한 원소는 모두 유사한 화학적 특성을 가지고 있습니다. 이러한 원자는 다른 원소와 반응하기 위해 전자 하나를 쉽게 내줍니다. 전자를 쉽게 내주는 능력은 이러한 원소를 우수한 도체 로 만듭니다 .
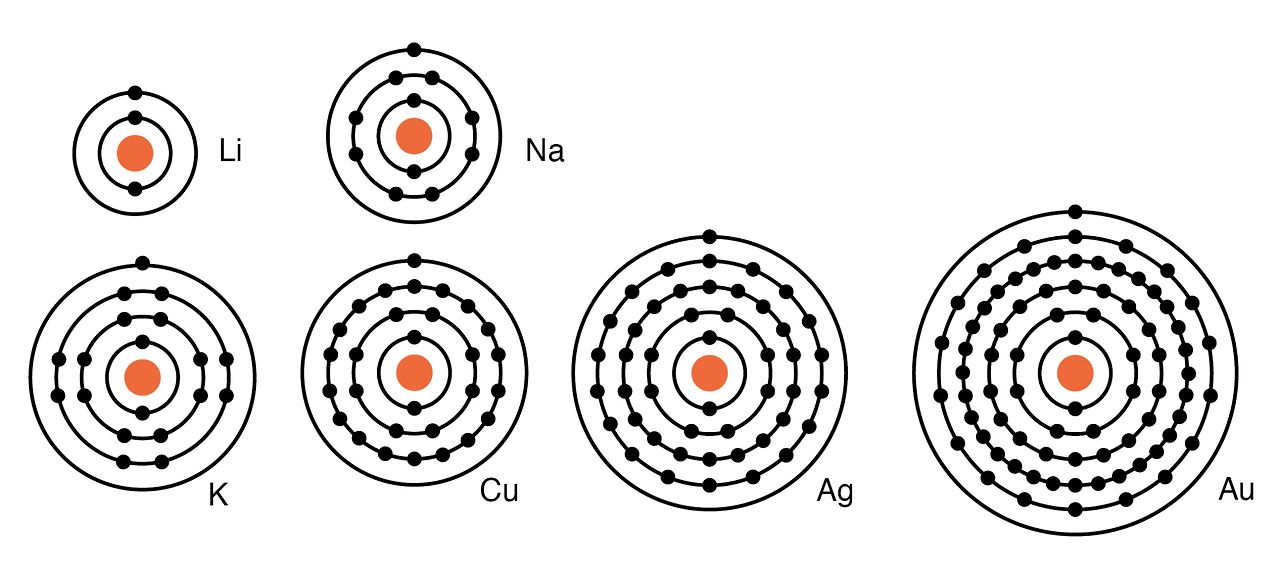
주기율표 IA족 원소: Li, Na, K, 그리고 IB족 원소: Cu, Ag, Au는 외부 또는 원자가 껍질에 전자 하나를 가지고 있으며, 이는 쉽게 기증됩니다. 내부 껍질 전자: n= 1, 2, 3, 4; 2n 2 = 2, 8, 18, 32.
절연체
VIIA족 원소: Fl, Cl, Br, I는 모두 외부 껍질에 7개의 전자를 가지고 있습니다. 이러한 원소는 외부 껍질을 8개의 전자로 채우기 위해 전자를 쉽게 받아들입니다. (아래 그림) 이러한 원소가 전자를 받으면 중성 원자에서 음이온이 형성됩니다. 전자를 포기하지 않는 이러한 원소는 절연체 입니다 .
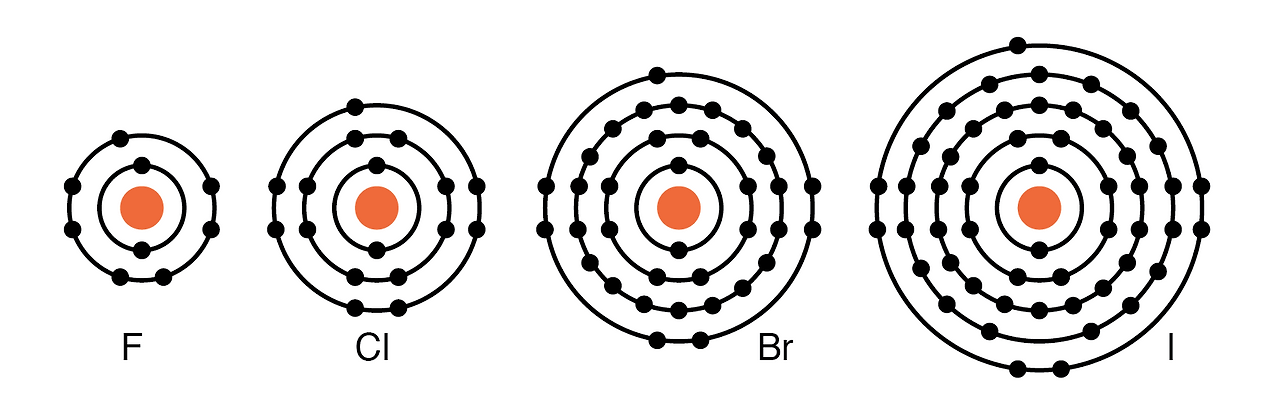
주기율표의 VIIA족 원소: 7개의 원자가 전자를 가진 F, Cl, Br, I는 다른 원소와 반응하여 전자를 쉽게 받아들인다.
예를 들어, Cl 원자는 아래 그림과 같이 Na 원자로부터 전자를 받아 Cl - 이온 이 됩니다 . 이온 은 전자를 기증하거나 수용하여 원자에서 형성된 하전된 입자입니다. Na 원자가 전자를 기증하면 Na + 이온이 됩니다. 이것이 Na와 Cl 원자가 결합하여 NaCl, 식탁소금을 형성하는 방식이며, 실제로는 Na + Cl - , 이온 쌍입니다. 반대 전하를 띠는 Na + 와 Cl - 는 서로를 끌어당깁니다.

중성 나트륨 원자는 중성 염소 원자에 전자를 기증하여 Na + 와 Cl- 이온 을 형성합니다 .
염화나트륨은 아래 그림에 표시된 입방 구조로 결정화됩니다. 이 모델은 3차원 구조를 보여주기 위해 축척되지 않았습니다. Na + Cl - 이온은 실제로 쌓인 구슬 층과 유사하게 포장되어 있습니다. 쉽게 그릴 수 있는 입방 결정 구조는 고체 결정이 대전된 입자를 포함할 수 있음을 보여줍니다.
VIIIA족 원소: He, Ne, Ar, Kr, Xe는 모두 원자가 껍질에 8개의 전자를 가지고 있습니다. (아래 그림) 즉, 원자가 껍질이 완전하다는 것은 이러한 원소가 전자를 기증하거나 받지 않는다는 것을 의미합니다. 또한 VIIIA족 원소는 다른 원소와 쉽게 결합하지 않기 때문에 화학 반응에 쉽게 참여하지 않습니다. 최근 몇 년 동안 화학자들은 Xe와 Kr이 몇 가지 화합물을 형성하도록 강요했지만, 논의의 목적을 위해서는 이는 적용되지 않습니다. 이러한 원소는 좋은 전기 절연체이며 실온에서 기체입니다.

7A족 원소(He, Ne, Ar, Kr, Xe)는 원자가 껍질이 완전하기 때문에 대부분 반응성이 없습니다.
반도체
그룹 IVA 원소: C, Si, Ge는 아래 그림과 같이 원자가 껍질에 4개의 전자를 가지고 있으며, 이온을 형성하지 않고 다른 원소와 전자를 공유하여 화합물을 형성합니다. 이 공유 전자 결합은 공유 결합 이라고 합니다 . 중심 원자(및 확장하여 다른 원자)가 전자를 공유함으로써 원자가 껍질을 완성했다는 점에 유의하십시오. 이 그림은 결합의 2차원 표현이지만 실제로는 3차원이라는 점에 유의하십시오. 반도체 특성 때문에 우리가 관심을 갖는 것은 바로 이 그룹 IVA입니다.

(a) IVA족 원소: C, Si, Ge는 원자가 전자껍질에 4개의 전자를 가지고 있습니다. (b) 다른 원소와 전자를 공유하여 원자가 전자껍질을 완성합니다.
결정 구조: 대부분의 무기 물질은 원자(또는 이온)를 결정 이라고 알려진 정렬된 배열로 형성합니다 . 원자의 바깥쪽 전자 구름은 질서 있게 상호 작용합니다. 심지어 금속조차도 미시적 수준에서 결정으로 구성됩니다. 금속 샘플에 광학적 연마를 한 다음 산 에칭을 하면 아래 그림과 같이 미시적 미세 결정 구조가 나타납니다. 상당한 비용을 들여 전문 공급업체에서 금속 단결정 표본을 구매할 수도 있습니다. 이러한 표본을 연마하고 에칭하면 미세 결정 구조가 드러나지 않습니다. 거의 모든 산업용 금속은 다결정입니다. 반면 대부분의 현대 반도체는 단결정 소자입니다. 우리는 주로 단결정 구조에 관심이 있습니다.

(a) 금속 샘플, (b) 광택 처리, (c) 미세결정 구조를 보여주기 위해 산 에칭 처리됨.
많은 금속은 부드럽고 다양한 금속 가공 기술에 의해 쉽게 변형됩니다. 미세 결정은 금속 가공에서 변형됩니다. 또한 원자가 전자는 결정 격자 주변과 결정에서 결정으로 자유롭게 이동할 수 있습니다. 원자가 전자는 특정 원자에 속하지 않고 모든 원자에 속합니다.
아래 그림의 단단한 결정 구조는 양이온 Na 이온과 음이온 Cl 이온의 규칙적으로 반복되는 패턴으로 구성되어 있습니다. Na와 Cl 원자는 Na에서 Cl로 전자를 전달하여 자유 전자 없이 Na + 와 Cl - 이온을 형성합니다. 전자는 금속과 비교하여 결정 격자를 자유롭게 움직일 수 없습니다. 이온도 자유롭지 않습니다. 이온은 결정 구조 내에서 제자리에 고정되어 있습니다. 그러나 NaCl 결정이 물에 용해되면 이온이 자유롭게 움직일 수 있습니다. 그러나 결정은 더 이상 존재하지 않습니다. 규칙적이고 반복되는 구조는 사라졌습니다. 물이 증발하면 반대 전하를 띤 이온이 서로를 끌어당기면서 새로운 결정 형태로 Na + 와 Cl - 이온이 침전됩니다. 이온성 물질은 반대 전하를 띤 이온의 강한 정전기적 인력으로 인해 결정 구조를 형성합니다.

입방형 str을 갖는 NaCl 결정 14족(이전에는 4족의 일부)의 반도체는 원자 주위의 s 및 p 궤도 전자를 활용하여 사면체 결합 패턴을 형성하고, 4개의 인접한 원자와 전자 쌍 결합을 공유합니다.(아래 그림(a)). 14족 원소는 4개의 바깥쪽 전자를 갖습니다. 2개는 구형 s 궤도에 있고 2개는 p 궤도에 있습니다. p 궤도 중 하나는 비어 있습니다. 3개의 p 궤도는 s 궤도와 혼성화되어 4개의 sp3 분자 궤도를 형성합니다 . 이 4개 전자 구름은 아래 그림과 같이 양전하 핵에 의해 끌려 Si 원자 주위의 등거리 사면체 간격으로 서로를 밀어냅니다.

1개의 s 오비탈과 3개의 p 오비탈 전자가 혼성화되어 4개의 sp3 분자 오비탈을 형성 합니다 .
모든 반도체 원자, Si, Ge 또는 C(다이아몬드)는 공유 결합 , 공유 전자 결합을 통해 다른 네 원자와 화학적으로 결합됩니다 . 두 전자는 각각 반대 스핀 양자수를 갖는 경우 궤도를 공유할 수 있습니다 . 따라서 짝을 이루지 않은 전자는 다른 원자의 전자와 궤도를 공유할 수 있습니다. 이는 전자 구름 또는 결합의 아래 그림(a)의 겹치는 그림에 해당합니다. 아래 그림(b)은 원점에서 아래 그림에 표시된 다이아몬드 결정 구조 단위 셀의 부피의 1/4입니다. 결합은 다이아몬드에서 특히 강하고, IV 그룹으로 내려가 실리콘과 게르마늄으로 갈수록 강도가 감소합니다. 실리콘과 게르마늄은 모두 다이아몬드 구조의 결정을 형성합니다.

(a) Si 원자의 사면체 결합. (b) 입방 단위 셀의 1/4로 이어짐
다이아몬드 단위 셀은 기본적인 결정 구성 요소입니다. 아래 그림은 셀의 부피 내에서 다른 네 개와 결합된 네 개의 원자(어두운 색)를 보여줍니다. 이것은 위 그림(b) 중 하나를 아래 그림의 원점에 배치한 다음, 인접한 면에 세 개를 더 배치하여 전체 큐브를 채우는 것과 같습니다. 여섯 개의 원자가 여섯 개의 큐브 면의 중앙에 떨어져 두 개의 결합을 보여줍니다. 인접한 큐브에 대한 다른 두 개의 결합은 명확성을 위해 생략되었습니다. 여덟 개의 큐브 모서리 중 네 개의 원자가 큐브 내의 원자와 결합합니다. 다른 네 개의 원자는 어디에 결합되어 있습니까? 다른 네 개는 결정의 인접한 큐브에 결합합니다. 큐브에서 네 개의 모서리 원자가 결합을 보이지 않더라도 결정 내의 모든 원자는 하나의 거대한 분자에 결합되어 있다는 점을 명심하십시오. 반도체 결정은 이 단위 셀의 사본으로 구성됩니다.
Si, Ge, C(다이아몬드)가 서로 엇갈린 면심 입방체를 형성합니다.

결정은 사실상 하나의 분자입니다. 원자는 다른 네 개와 공유 결합하고, 그 네 개는 다시 다른 네 개와 결합합니다. 결정 격자는 비교적 단단하여 변형에 저항합니다. 결정 주위에서 전도를 위해 자유로워지는 전자는 거의 없습니다. 반도체의 특성 중 하나는 전자가 자유로워지면 양전하를 띤 빈 공간이 생겨 전도에 기여한다는 것입니다.
검토
- 원자는 완전한 바깥쪽, 원자가, 8개 전자(가장 안쪽 껍질은 2개 전자)로 이루어진 껍질을 형성하려고 합니다. 원자는 몇 개의 전자를 기부하여 밑에 있는 8개 껍질을 노출시키거나, 몇 개의 전자를 받아들여 껍질을 완성하거나, 전자를 공유하여 껍질을 완성할 수 있습니다.
- 원자는 종종 결정이라고 불리는 단단한 구조 내에서 이온이나 원자의 질서 있는 배열을 형성합니다.
- 중성 원자는 전자를 기증하여 양이온을 형성할 수 있습니다.
- 중성 원자는 전자를 받아들여 음이온을 형성할 수 있습니다.
- 그룹 IVA 반도체: C, Si, Ge는 다이아몬드 구조로 결정화됩니다. 결정의 각 원자는 거대한 분자의 일부이며, 다른 네 개의 원자와 결합합니다.
- 대부분의 반도체 소자는 단결정으로 제조됩니다.